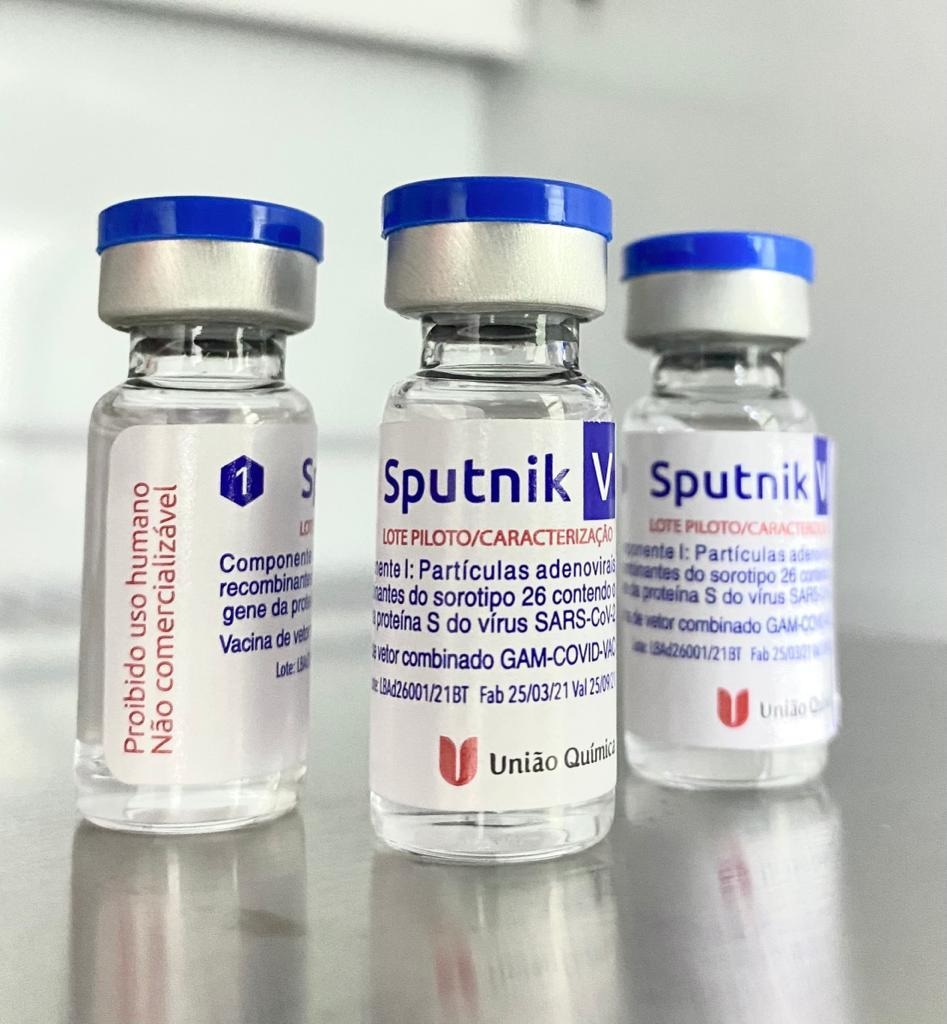
O Presidente do Grupo União Química, Fernando de Castro Marques, apresentou ao novo Embaixador Russo no Brasil, Alexey Labetskiy, e para autoridades do Ministério da Saúde, na tarde de 30 de março, na unidade de Biotecnologia da farmacêutica, a BTHEK em Brasília, o 1º lote piloto de transferência tecnológica do IFA da Sputnik V, 100% produzido pela farmacêutica em território brasileiro. Esse lote será integralmente enviado para Moscou, na Rússia, para validação.
A União Química reitera seu pioneirismo na produção de imunizante contra Covid-19 produzido no Brasil.
Além disso, a Anvisa, aprovou (com publicação no Diário Oficial da União), o processo de certificação da planta fabril da União Química em Guarulhos – a Inovat Indústria Farmacêutica – que será responsável pelas operações de formulação, esterilização e envase da vacina (processo asséptico), com o insumo farmacêutico ativo que deve ser fabricado nas instalações da Bthek, em Brasília. A inspeção ocorreu para a verificação das condições técnico-operacionais (CTO) da empresa, no período de 8 a 12 de março de 2021, devido às modificações na área fabril efetuadas para adequar o processo de fabricação da vacina Sputnik V.
A vacina Sputinik V já obteve a autorização de uso em 58 países, com eficácia comprovada de 91,6% e ausência de reações adversas relevantes, tornando a Sputnik V um dos mais seguros e eficazes imunizantes contra a Covid-19 em uso no mundo.
Histórico
A União Química ingressou com um primeiro pedido de uso emergencial da vacina Sputnik, na Anvisa, em 15 de janeiro, e desde então está em contato com o Fundo Russo de Investimentos Diretos (RDIF) e com o Instituto Gamaleya, para atender às exigências colocadas à época pela Anvisa. Devido a aprovação da nova lei 14124/21 e a RDC 475/21, a União Química decidiu cancelar o primeiro pedido de uso emergencial e solicitar um novo, o que ocorreu no dia 26 de março de 2021. O processo submetido contém mais de 14.000 páginas de documentos com o objetivo de comprovar a qualidade, segurança e eficácia da vacina Sputnik V. Conforme previsto no rito de análise da Anvisa, foi realizada a triagem documental nas primeiras 24 horas após a submissão e foi enviado ofício à União Química solicitando a complementação desta.
Conforme já divulgado pela Anvisa, não houve interrupção da análise da documentação apresentada, sendo que até o momento, a análise dos documentos está em 62%. A União Química segue em tratativas com os desenvolvedores da vacina para complementar as informações solicitadas pela Anvisa.